北海道大学大学院医学院 放射線科学講座 画像診断学教室
教授工藤 與亮内科系
- 1995年、北海道大学 医学部医学科 卒業
- 1995年、同大学 医学部附属病院 放射線科 医員(研修医)
- 1995年、厚生連総合病院 旭川厚生病院 放射線科 医師
- 1996年、北海道大学 医学部附属病院 放射線科 医員(研修医)
- 1997年、医療法人禎心会 セントラルCIクリニック 院長
- 2003年、北海道大学 医学部附属病院 放射線科 医員
- 2004年、同大学大学院 医学研究科 放射線医学分野 助手
- 2006年、米国 Wayne State University MR Research Center 留学
- 2007年、北海道大学病院 放射線科 助教
- 2008年、岩手医科大学 先端医療研究センター 講師
- 2013年、北海道大学病院 放射線部 准教授、放射線診断科長
- 2019年、同大学大学院 医学研究院 放射線科学分野 画像診断学教室 教授
自作プログラミングを駆使して新しい画像解析法やMRI造影剤を開発

今日の医療の高度化、精緻化に伴い、CT、MRI、PETといった医用画像診断技術も高速で進化を遂げてきました。自ら設計・プログラミングしたソフトウェアで、脳や脊髄等の画像診断の研究開発、商品化を推進し、複数の画像診断技術を一元化したマルチモダリティによる技術革新の一翼を担ってきたのが、画像診断学教室と北海道大学病院の二つの診療科[1]を率いる工藤與亮教授です。
大学院在学中に「医学生時代に趣味でやっていたコンピューター・プログラミングを研究に生かそう」と思い立った工藤教授は、自らが組み込んだプログラムで、CTとMRI技術を融合した脳血流(灌流)の画像解析を高速で処理するソフトウェアの開発を行いました。2006年よりフリーウェア「PMA(perfusion mismatch analyzer)」としての公開を行い、2019年には「PMAneo」として薬事認証を取得しました。このPMAソフトウェアは工藤教授のさまざまな画像処理研究のプラットフォームにもなっています。
他方で、MRIの基本原理である物質の磁化率(物質ごとに異なる磁化の起こりやすさ)を利用して、脳の酸素代謝を可視化する研究を始め、血流低下、過呼吸、薬剤負荷などの条件により変動する脳内の脱酸素化ヘモグロビン量を磁化率に換算して、そこから酸素摂取率(酸素代謝)の変化をマップ化(画像化)するアルゴリズムを考案しました。
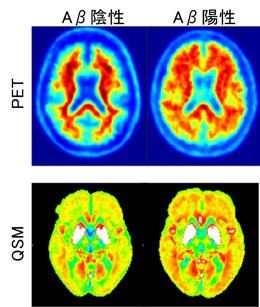
この磁化率による解析手法を、アルツハイマー型認知症の診断にも応用できると考えた工藤教授は、2016年より日立製作所と共同でアルツハイマー型認知症の早期診断を目指し、検査時間の大幅な短縮を可能にする新しいMRI撮像法・解析法の研究開発に着手しました。
アルツハイマー型認知症患者の脳に蓄積する異常なタンパクAβ(アミロイド・ベータ)に結合する鉄成分の磁化率を定量化し、鉄沈着状態を可視化する技術QSM(Quantitative Susceptibility Mapping)の解析手法を構築し、これと従来の診断法である脳の萎縮の程度を客観的に評価するVBM(Voxel Based Morphometry)と組み合わせることで、短時間で人体に優しいMRI検査法が誕生しました。「従来のVBM診断法だけでは、診断がつくのは認知症の発生後になってしまいますが、鉄の沈着はもっと初期段階で起きているので、そこを見つけることが早期発見につながります」(工藤教授)
安心安全な17O標識水(MRI造影剤)で体内の水の動きを可視化
現在、工藤教授が注力するのは、酸素同位体の中でも唯一MRIで検出が可能で人体に無害という安定同位体17O(酸素-17)を活用した新しい画像診断技術の開発です。17OをMRI撮像時の造影剤(標識水、水分子トレーサー)として投与することにより、体内の組織を流動する水の分布を可視化できることに着目しました。
脳・脊髄の画像診断を専門とする工藤教授は、この17O標識水の投与により、認知症患者などの脳で、細胞外に溜まった老廃物を洗い流すリンパ液の役割を担っているとされるグリンパティック・システムの水動態(水分子の動き)を、同位体顕微鏡(ミクロ)からMRI撮像(マクロ)までのマルチスケールで観察する研究に着手しました。
「国産初のMRI造影剤を開発し、国際的にもオリジナリティーの高い17O標識水の研究成果は、北大という恵まれた環境のたまもの」と語る工藤教授。「北大病院の臨床研究開発センター (世界レベルの医療技術創出を目的として2014年開設)の協力により、17O標識水をヒトに安全に投与できるGMP無菌製剤『PSO17』として開発することができました。また、北大にしかない創成研究機構の同位体顕微鏡[2]で、細胞の内外を水がどのように分布して動いていくかをミクロレベルで直に観察できるのは大きなメリットです。真空撮影により試料の水分が蒸発してしまうという顕微鏡特有の課題も創成研が凍結切片を用いた手法を発明して解決してくれました」
17O標識水の薬事申請へ向けて臨床研究開発センターの早期臨床試験支援部門「PhaseⅠUnit」の最初の利用者となり、健康成人を対象とした医師主導第Ⅰ相治験を行った工藤教授は、すでに第Ⅱ相臨床研究を開始しています。「健康な人で安全だということがわかってきたので、少しずつ患者さんに投与を始めたところです。数年内には認知症や水頭症などの患者さんで有用性が明らかになり、薬事承認まで行ければと考えています。さらに全身の臓器、疾患や革新的な治療戦略への応用も視野に、異分野融合として他大学や他部門との連携を図っているところです」
修士課程1年の仲田有美さんは、亀田浩之助教とともに17O標識水をテーマに研究を行っています。「中枢神経の医療画像を読影する際、現在の解析手法では臨床の疑問を解消するには不十分と感じてきました。水の動態は追跡するのが難しいので、それを可能にした人体に無害な造影剤の存在は非常に魅力的です」と亀田医師。仲田さんは「北大の保健学科で放射線技術を専攻し、脳機能のファンクショナルMRIの研究を行っていました。工藤先生の元でMRIに関する最新の情報を得ながら研究を続けたい」と明かします。
工藤教授は「検査前のスケジューリングに始まり、検査画像を高精細にする、画像のどこに病変があるかを自動で検出し、それが何かを診断する、といった画像診断のあらゆる工程でAI技術が組み込まれ、日進月歩で研究開発されています。私たちは多臓器・多モダリティ(全身の臓器×あらゆる検査手法)を教室全体でカバーし、それぞれの興味に応じた多彩な領域で多くの研究を行っています。まずは全身の画像診断に精通した上で、好きな領域を見つけて、そこはとんがって伸ばしていってほしい。画像診断やAIに興味がある方は、ぜひ一緒に研究開発をやりましょう」と呼びかけます。
「2020年9月に東北大学(主幹校)、北海道大学、岡山大学の三大学が立ち上げたAI人材育成プロジェクトが文科省に採択されましたので、医療系のAI研究を集約して、医用AI開発を推進できる人材を育成するという計画を立てています。AI技術で医療ニーズに応える多彩なアイディアとの出会いが待ち遠しいです」

[1] ^ CT(コンピュータ断層診断装置)やMRI(磁気共鳴画像装置)による画像診断、IVR(Interventional Radiology)による治療を行う放射線診断科 とPET(陽電子放出断層撮影)、SPECT(脳血流シンチグラフィー)を用いた核医学診断、治療を行う核医学診療科
[2] ^ 北大理学研究院の圦本尚義教授らが開発し、2010年に小惑星探査機「はやぶさ」が持ち帰った小惑星「イトカワ」の微粒子の解析を行った世界でただ一つの同位体顕微鏡。安定同位元素(安定同位体)のイメージング(画像化、視覚化)を初めて可能にした。2020年12月に「はやぶさ2」が持ち帰った小惑星「リュウグウ」の砂の解析も手がける。
(取材:2020年10月)
出前授業で高校生に画像診断、医用AIの魅力をレクチャー

毎年開催する北大のさまざまな分野の研究者による高校生向け出前授業「アカデミック・ファンタジスタ」で、工藤教授や平田健司准教授が高校生を相手に、MRI、脳の画像診断の仕組み、医用AI、現在着手している研究等のレクチャーを行っています。「フリーの開発環境を駆使して高校生ながらにAIに取り組んでいたり、MRI検査を受けたことのある高校生もいたりして、質疑応答の時間は盛り上がります。画像診断に好奇心旺盛な高校生を青田刈りしたいという野望を秘めつつ(笑)授業に臨んでいます」